Gases
Por Oliver Lagos
Propiedades generales de los gases
- Los gases son compresibles: dependerá de la presión a la cual se somete y afecta al volumen del gas.
- Los gases son compresibles: dependerá de la presión a la cual se somete y afecta al volumen del gas.
- Los gases se expanden: Se adecuan al recipiente que los contiene, es decir e volumen del gas es igual al recipiente que los contiene.
- Los gases forman mezclas homogéneas: Se mezclan fácilmente para formar mezclas homogéneas sin importar las identidades ni las proporciones relativas de los gases componentes.
- Los gases se componen de moléculas independientes: Las propiedades de los gases se deben a que las moléculas están relativamente alejadas unas de otras.
Características de los gases
- En condiciones ordinarias los elementos NO METALICOS existen como gases.
- Los gases simples son generalmente diatómicos (por ejemplo O2 F2 Cl2 H2 N2).
- Los gases nobles son monoatómicos y poco reactivos.
- Los líquidos y sólidos también existen como gases, estos se llaman vapores.
Variables que afectan al estado gaseoso


La presión en los fluidos
La presión se define como la fuerza que actúa normalmente sobre una unidad de área:
- Según la 1 ley de Newton:

Entonces:
Presión = altura x densidad del fluido x aceleración debida a la gravedad
Presión = en pascales
Altura = en metros
Densidad = Kg/m3Aceleración debida a la gravedad = 9.81 m/s2
Leyes de los gases
Condiciones TPN (temperatura y presión normal): Estas se han definido como 0 °C ó 273 K y 1atm ó 101325 Pa
Ley de Boyle: “Si la presión de un gas aumenta al doble de la presión inicial y la temperatura permanece constante, el volumen del gas disminuirá a la mitad”.
Relaciona: presión (P) y volumen (V)
Constantes: cantidad de materia y temperatura
Condiciones TPN (temperatura y presión normal): Estas se han definido como 0 °C ó 273 K y 1atm ó 101325 Pa
Ley de Boyle: “Si la presión de un gas aumenta al doble de la presión inicial y la temperatura permanece constante, el volumen del gas disminuirá a la mitad”.
Relaciona: presión (P) y volumen (V)
Constantes: cantidad de materia y temperatura
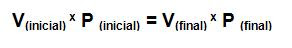
Ley de Charles: “El volumen de una cantidad fija de gas mantenida a presión constante es directamente proporcional a su temperatura absoluta”.
Relaciona: Volumen (V) y temperatura absoluta (K)
Constantes: Presión y cantidad de materia

Ley de Gay- Lussac: “A volumen constante, la presión de un gas aumenta proporcionalmente al incremento de temperatura”.
Relaciona: Presión (P) y temperatura absoluta (K)
Constantes: Volumen y cantidad de materia

Ley de Avogadro: “El volumen de un gas mantenido a temperatura y presión constantes es directamente proporcional al número de moles del gas”.
Relaciona: Cantidad de materia (n) y volumen (V)
Constantes: Presión y Temperatura
 Ley combinada de los gases: Relaciona la ley de Boyle y la ley de Charles:
Ley combinada de los gases: Relaciona la ley de Boyle y la ley de Charles:Ley de Boyle: V ∞ 1/P
Ley de Charles: V ∞ T
 Gas ideal: Es aquel gas hipotético que responde a la ecuación del gas ideal, quiere decir que su comportamiento P, V, y T se describe perfectamente con la ecuación de gas ideal.
Gas ideal: Es aquel gas hipotético que responde a la ecuación del gas ideal, quiere decir que su comportamiento P, V, y T se describe perfectamente con la ecuación de gas ideal.Ecuación del gas ideal: Relaciona las leyes de Boyle, Charles y Avogadro.
Ley de Boyle: V ∞ 1/P
Ley de Charles: V ∞ T
Ley de avogadro: V ∞ n
PV= nRT
P = Presión
V = Volumen
n = número de moles
R = constante de proporcionalidad
T = temperatura
Valor Constante de proporcionalidad: El valor corresponde a las unidades de V, P y T.
V = Volumen
n = número de moles
R = constante de proporcionalidad
T = temperatura
Valor Constante de proporcionalidad: El valor corresponde a las unidades de V, P y T.

Densidad y masa molar: Podemos calcular la densidad y la masa molar aplicándola a la ecuación del gas ideal.
 Volumen molar de un gas: El volumen de un mol de un gas ideal en condiciones normales de presión y temperatura TPN es de 22,41 Litros
Volumen molar de un gas: El volumen de un mol de un gas ideal en condiciones normales de presión y temperatura TPN es de 22,41 LitrosPresión parcial: Es la presión ejercida por un componente dado (gas) en una mezcla de gases. Se define como el producto entre la presión total y su fracción molar en la mezcla:
Donde la fracción molar:

Ley de las presiones parciales de Dalton: “La presión total de una mezcla de gases es igual a la suma que cada gas ejercería si estuviera presente sólo”, quiere decir que la presión total es la suma de las presiones parciales.


Presión total (obtención de un gas sobre agua): La presión total es la suma de la presión del gas obtenido sobre agua y la presión del vapor de agua en equilibrio con el agua liquida.

Ley de las presiones parciales de Dalton: “La presión total de una mezcla de gases es igual a la suma que cada gas ejercería si estuviera presente sólo”, quiere decir que la presión total es la suma de las presiones parciales.


Presión total (obtención de un gas sobre agua): La presión total es la suma de la presión del gas obtenido sobre agua y la presión del vapor de agua en equilibrio con el agua liquida.
 * La presión del vapor de agua es una cantidad tabulada
* La presión del vapor de agua es una cantidad tabuladaPresión en recipientes cerrados y presión manométrica: Es la presión obtenida en un manómetro de mercurio, se define según las características siguientes:
- En un recipiente cerrado: la presión del gas es igual a la diferencia de altura en las ramas (Ph1).

- En un recipiente de extremo abierto: Dependiendo si la presión del gas es mayor o menor a la presión atmosférica:
1) si la presión del gas es menor que la presión atmosférica:
La formula (b) sólo puede ser usada si la primera rama es mayor que la rama que da al extremo abierto.

2) si la presión del gas es mayor que la presión atmosférica:
La fórmula (c) sólo puede ser usada si la primera rama que da al recipiente cerrado es menor que la rama que da al extremo abierto
- BROWN T., LeMAY Jr., BURSTEN B., Química La ciencia central. Editorial Prentice Hall Hispanoamericana SA. 1998. Séptima edición
- CHANG R. Química. Editorial Mc Graw Hill. México.1992. Primera edición en español.
WHITTEN, GAILEY y DAVIS. Química General. Editorial Mc Graw Hill. México. 1992. Segunda edición en español. - ATKINS y JONES. Química. Moléculas. Materia. Cambio. Ed. Omega S.A. 1998. Tercera edición




No hay comentarios:
Publicar un comentario