Química general
Soluciones
Por Oliver Lagos Rojas
1. Definición
Solución: Mezcla homogénea de dos o más sustancias.
2. Tipos de soluciones
Soluciones sólidas: aleación Ni-Cu, latón amarillo (Cu-Zn).
Soluciones Líquidas: sal en agua, agua de mar, vinagre.
Soluciones gaseosas: aire atmosférico, gas natural.
3. Composición de las soluciones
Soluto: Sustancia presente en menor cantidad.
Solvente: Sustancia presente en mayor cantidad y disuelve al soluto.
Solución: soluto + solvente
4. Unidades de concentración
4.1. Unidades Físicas
- % en masa: Se define como gramos (g) de soluto en 100 gramos (g) de solución.

- % masa- volumen: Se define como los gramos (g) de soluto en 100 mililitros (mL) de solución.

*% (masa/volumen) = Densidad x % en masa (m/m)
- % en volumen: Se define como mililitros (mL) de soluto en 100 mililitros (mL) de solución.

- Concentración gramos- litros: Se define como los gramos (g) de soluto en 1 litro (L) de solución.

- Partes por millón (PPM): En concentraciones muy diluidas se define como los miligramos (mg) de soluto en 1 litro (L) de solución.

*Relación partes por millón con % en masa

- Partes por billón (PPB): Se define como 1 miligramo (mg) de soluto en 1 billón de miligramos (mg) de solución.

5. Unidades Químicas
- Número de moles: Para adentrarse en las unidades químicas debemos conocer el número de moles, se define como gramos (g) de soluto en su masa molar (M).

- Molaridad (M): Se define como moles de soluto en 1 litro (L) de solución.


- Molalidad (m): Se define como moles de soluto en 1 kilogramo (Kg) de solvente.

- Número de equivalentes (N° Eq/mol): La definición de un equivalente dependerá del tipo de sustancia de que se trate:
-- Para sales: Es el número de moles de carga positiva o negativa por mol de sal, cuando este disociada completamente.
-- Para acidos y bases: Es el número de hidrógenos (H+) o de hidroxilos (OH-) respectivamente que pueden disociarse.
- Masa equivalente o peso equivalente (Meq): Se define como el peso molecular (M) por número de equivalentes (Eq/mol).

- Equivalentes de un soluto (Eq): Se define como la masa del soluto en gramos (g) por gramo- equivalente (g/Eq) de masa equivalente (Meq).

- Normalidad (N): Se define como equivalentes de soluto (Eq) por litro (L)de solución.

- Fracción molar (X): Se define como la fracción de los moles de un componente en los moles totales de todos lo componentes.

- Concentración de iones: Las sustancias que se disocian en una solución dejarán iones en ellas, un electrolito fuerte se disocia un 100%, entonces la concentración de estos iones en la solución:

Otro ejemplo: En una solución 2M de sulfato de aluminio

6. Dilución
Ley de la dilución: Al agregar agua a una disolución cambia la concentración (disminuye) y el volumen (aumenta) NO así el número de moles.
Número de moles iniciales = Número de moles finales
Volumen inicial <>
Concentración inicial > concentración final
Puesto que el número de moles no cambia se puede escribir la siguiente ecuación:
 Donde:
Donde:
C = concentración
V = volumen
1 = inicial
2 = final
Mezcla de soluciones: Al mezclar dos o más soluciones que pueden ser de un mismo soluto o de diferente soluto sigue las siguientes reglas:
- Los volúmenes de diferentes líquidos NO son aditivos.
- Los volúmenes de líquidos iguales y de diluciones relativas son aditivos.
- Los moles de soluto y las masas son aditivos.
- Las molaridades NO son aditivas, la molaridad final M3 se calculan a partir de n3 y v3.

Soluciones acuosas: Son aquellas en las que el solvente es agua.
Electrolitos: Sustancia cuyas soluciones contienen iones y por tanto conducen la electricidad. (Ej.: NaCl)
- Electrolito fuerte: Existen completamente o casi completamente como iones en una solución.
- Electrolito débil: Se disocian parcialmente en pequeñas cantidades.
NO confudir el grado de solubilidad con la calidad de fuerte o débil.
No electrolitos: Sustancia que no forma iones en solución y por tanto no conduce la electricidad. (Ej.: C12H22O11)
Compuestos iónicos en agua: Generalmente se disocian completamente en agua, son electrolitos.
En cuanto a los compuestos iónicos pueden ser
Electrolitos fuertes: NaCl, NH4Cl, NaOH, KOH, Ba(OH)2.
Electrolitos débiles: PbCl2, HgCl2, HCN (ácido cianhídrico), HF (ácido sulfurhídrico), H3PO4 ( Ácido fosfórico).
Compuestos moleculares en agua: Generalmente conservan su integridad estructural o se disuelven en baja cantidad
En cuanto a los compuestos moleculares pueden ser.
- No electrolitos: CH3OH (metanol).
- Electroito débil: CH3COOH (ácido acético), CH3 (metano), CH3NH2 (metil amina), NH3 (amoniaco).
- Electrolito fuerte: HCl (ácido clorhídrico), HNO3 ( ácido nítrico).
7. Equilibrio quimico
Los electrolitos débiles se disocian y se vuelven a formar equilibrando las concentraciones de moléculas neutras e iones hasta llegar a un estado de equilibrio, las ecuaciones para electrolitos débiles y fuertes son:
Electrolitos débiles:

Electrolitos fuertes:

8. Ácidos Son sustancias que pueden ionizarse para formar un Ion hidrógeno o protón y así aumentar la concentración de iones H+(ac) o protones en soluciones acuosas.
-- Ácidos monoproticos: Se ioniza para entregar un solo protón al medio.

-- Ácidos diproticos: Se ionizan para entregar dos protones al medio.

Ácidos fuertes:
- Monoproticos: HCl, HBr, HNO3, HI, HClO3 y HClO4
- Diproticos: H2SO4
Ácidos débiles: HSO4-, H3PO4, HF, HC2H3O2, H2CO3, H2S, H2PO4-,NH4+, HCO3-, HPO42- .
9. Bases
Son sustancias que aceptan protones o reaccionan con iones H+.
Generalmente son bases los que contienen iones OH- , que se disocian en la solución y aumentan su concentración.
Bases fuertes: H-, O2-, S2-, Hidróxidos iónicos de metales alcalinos del grupo IA y alcalinos térreos del grupo IIA.
Bases débiles: PO43-, CO32-, NH3, HPO42-, HS-, NH2CH3
9. Reacciones de Neutralización
Si se mezclan en una solución un ácido y una base, ocurre una reacción de neutralización, los productos de la reacción no conservan las propiedades del ácido ni de la base.
La reacción de neutralización entre un ácido y un hidroxilo metálico produce agua y una sal:

Neutralización (1:1): para neutralizar un mol de ácido se requiere de un mol de base.

Como los moles de H+ deben ser iguales a los moles de OH- en toda neutralización, la formula a utilizar de la ley de dilución es:

Neutralización (1:2): Para neutralizar un mol, ya sea de ácido o de base, se necesitan dos moles del otro:


10. Titulación
Procedimiento para determinar la concentración desconocida de una solución mediante una segunda solución de concentración conocida, ésta se llama solución estándar la cual reaccionará con la solución de concentración desconocida.
Punto de equivalencia de titulación: Es el punto donde se reúnen cantidades estequiométricamente equivalentes.
11. Teoría clásica de Arrhenius
“Ácido es toda especie química que al disociarse en solución acuosa, libera iones (cationes) Hidrógenos, es decir iones H+ (Ej.: HCl) y base es toda especie química que al disociarse en solución libera iones (aniones) hidroxilo OH- (Ej.: NaOH). Sal son todas las sustancias iónicas que en solución acuosa, experimentan disociación, liberando cationes diferentes de H+ y aniones diferentes de OH-".
12. Teoría protónica de Lowry- Brönsted
“Ácido es toda especie química que en reacción cede “protones” (iones H+) y base es toda especie química que en reacción recibe “protones” (iones H+).

- Un ácido fuerte se conjuga en la base débil.
- Un ácido débil se conjuga en una base fuerte.
- Una base fuerte conjuga un ácido débil.
- Una base débil conjuga un ácido fuerte.
13. Teoría electrónica de Lewis
“Ácido es toda especia que puede recibir un par de electrones (especie de par libre en enlace dativo) y base es toda especie que puede aportar un par de electrones".

14. Tipos de ecuaciones
Ecuación molecular: Ecuación escrita con fórmulas químicas de reactivos y productos:

Ecuación Iónica completa: Ecuación química que describe las sustancias completamente ionizadas sólo si son electrolitos fuertes solubles o las moleculares completas en el caso que estas no se disocien, los iones que aparecen en fórmulas idénticas en los dos lados de la ecuación se denominan iones espectadores y no cumplen función alguna en la reacción.

Ecuación iónica neta: Ecuación química que sólo incluye los iones y moléculas que intervienen directamente en la reacción.

15. Solubilidad en compuestos iónicos
Para predecir la formación de un precipitado necesitamos pautas de solubilidad para los compuestos iónicos:

En el cuadro se refiere a cualquier sustancia con una solubilidad menor que 0.01 mol/L como insoluble.
Reacciones de metátesis: Reacciones de desplazamiento doble en las cuales iones positivos (cationes) e iones negativos (aniones) parecen cambiar de compañero:

Eliminación de iones en una solución: Para producir un cambio neto en la reacción se deben retirar iones de esta, este proceso actúa como fuerza impulsora para que la metátesis ocurra, los motivos pueden ser:
1) La formación de un producto insoluble o precipitado: En ellas se forma un sólido INSOLUBLE.
Ecuación molecular

Ecuación iónica neta

2) La formación de un electrolito débil o un no electrolito: En ellas se forma un electrolito débil o un no electrolito, el cual permanece disuelto en la reacción.
Ecuación molecular

Ecuación ionica neta

3) La formación de un gas: En ellas se forma un gas que escapa de la solución, ya que tiene baja solubilidad en agua.
Ecuación molecular

Ecuación ionica neta

Bibliografía
- Química: la ciencia central. Brown T., Le May H., Bursten B. Editorial Prentice Hall Hispanoamericana S.A. 1993.
- Química. Chang R. Editorial Mc Graw Hill Sexta edición.1998.
- Química para la Comunidad. American Chemical Society. Editorial Addison Wesley Iberoamericana. Segunda edición.1998.
- Química. Garritz A., Chamizo J. Editorial Addison Wesley Iberoamericana. 1994.
Fundamentos de la Ciencia e Ingeniería de materiales. Smith W. Editorial Mc Graw Hill. Segunda Edición. 1993. - Química General. Bottani E. Odetti H.S., Pliego O.H., Villarreal E. Editorial Universidad Nacional del Litoral. Santa Fe, 2001.



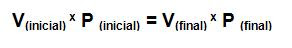


 Ley combinada de los gases: Relaciona la ley de Boyle y la ley de Charles:
Ley combinada de los gases: Relaciona la ley de Boyle y la ley de Charles: Gas ideal: Es aquel gas hipotético que responde a la ecuación del gas ideal, quiere decir que su comportamiento P, V, y T se describe perfectamente con la ecuación de gas ideal.
Gas ideal: Es aquel gas hipotético que responde a la ecuación del gas ideal, quiere decir que su comportamiento P, V, y T se describe perfectamente con la ecuación de gas ideal.
 Volumen molar de un gas: El volumen de un mol de un gas ideal en condiciones normales de presión y temperatura TPN es de 22,41 Litros
Volumen molar de un gas: El volumen de un mol de un gas ideal en condiciones normales de presión y temperatura TPN es de 22,41 Litros


 * La presión del vapor de agua es una cantidad tabulada
* La presión del vapor de agua es una cantidad tabulada


























 Donde:
Donde:





 Como los moles de H+ deben ser iguales a los moles de OH- en toda neutralización, la formula a utilizar de la ley de dilución es:
Como los moles de H+ deben ser iguales a los moles de OH- en toda neutralización, la formula a utilizar de la ley de dilución es:














